°°1Њѕ ≤љ≥Ў§»§ѕ≤њ§Ђ°љ≤ ≥Ў§ќ§ §Ђ§ќ≤љ≥Ў°љ
°°§≥§ќЊѕ§ќћд¬к§ѕ§є§ў§∆°§Ћ№ Є§дЊѕЋц§ќї≤єЌљс§д≤ ≥ЎїЋ(≤љ≥ЎїЋіё§а)іЎЈЄ§ќњёљс§ §…§тЉЂ§йƒі§ў§∆∆…Љ‘ЉЂњ»§ђЉЂЉз≈™§Ћ≤т≈ъ§т∞ъ§≠§ј§є§≥§»§тіь¬‘§Ј§њћд¬к§«§є°•§њ§ј§Ј°§6§»10§Ћ§ј§±°§Љгі≥§ќ•≥•б•у•»§тµ≠§Ј§ё§є°•
6°•Їљ≈ь(•Ј•з≈ь°§•є•ѓ•н°Љ•є)
°°°°Їљ≈ь§ќјЄїЇ§ѕ°§•≠•е°Љ•–§ §…§ќјЊ•§•у•…љф≈з§т√жњі§Ћ17ј§µ™Єе»ЊЇҐ§Ђ§й•µ•»•¶•≠•”§ќ¬зµђћѕЇѕ«Ё§Ћ§и§кјє§у§Ћє‘§п§м§л§и§¶§Ћ§ §к§ё§Ј§њ§ђ°§§љ§ќЇЁ§ќѕЂ∆ѓќѕ§»§Ј§∆јЊ•Ґ•’•к•Ђ§ќєхњЌ§ђ¬њњф≈џќм§»§Ј§∆ґѓј©≈™§ЋѕҐ§м§∆§≥§й§м§∆§§§ё§є°•љйіь§Ћ§ѕ°§≈џќм∞мњЌ§ќ√Ќ√ §ѕЇљ≈ьћу500kg§ЋЅк≈ц§Ј§∆§§§њ§љ§¶§«§є§ђ°§18ј§µ™ЋцЇҐ§Ћ§ѕЇљ≈ь2•»•уƒш≈ў§ќ√Ќ√ §«Љи∞ъ§µ§м§∆§§§њ§»§§§п§м§∆§§§ё§є°•Їљ≈ь§ѕ°§≤љ≥Ў≈™§Ћ§ѕ•÷•…•¶≈ь§»≤ћ≈ь§Ђ§й§ §л∆у≈ьќа§«°§•÷•…•¶≈ь§в≤ћ≈ь§вњ© ™§Ђ§йјЁЉи§«§≠§л ™ЉЅ§ §ќ§«°§§»§ѓ§ЋЇљ≈ь§тјЁЉи§Ј§ §ѓ§∆§в§и§§§ќ§«§є§ђ°§•≥°Љ•“°Љ§дє»√г§ §…§Ћ∆ю§м§∆∞ыЌ—§є§лљђіЈ§ђјЊЌќ§т√жњі§Ћјє§у§Ћ§ §к°§§љ§ќЈл≤ћЉыЌ„§ђЅэ¬з§Ј§∆§§§√§њ§в§ќ§«§є°•
°°°°∞мЉп§ќ”ѕє• ™ЉЅ§«§є§ђ°§•Ґ•л•≥°Љ•л§д•њ•–•≥(•Ћ•≥•Ѕ•у)§дЋгћф§ §…§»∆±ЌЌ§Ћ√њ≈Ѓј≠(addictive)§ђ§Ґ§кљђіЈј≠§ќ ™ЉЅ§»§в§§§®§ё§є§Ј°§»оЋю§д≈ь«Ґ…¬§д√оїх§ §…§ќЄґ∞ш ™ЉЅ§«§в§Ґ§к°§≤бЊкјЁЉи§ѕє•§ё§Ј§ѓ§Ґ§к§ё§ї§у°•
10°••Ґ•№•ђ•…•нƒкњф§тЇ«љй§Ћ¬ђƒк§Ј§њ§ќ§ѕ°§•™°Љ•є•»•к•Ґ§ќ•н•Ј•е•я•√•»(1821°Ѕ1895)§»§§§п§м§∆§§§ё§є§ђ°§•Ґ•№•ђ•…•нƒкњф§т¬њњф§ќ эЋ°§тЌ—§§§∆¬ђƒк§тїо§я§њњЌ ™§»§Ј§∆§ѕ°§•’•й•у•є§ќ•Є•г•у°¶•Џ•й•у(1870°Ѕ1942°І1926«ѓ§Ћ•ќ°Љ•ў•л ™Ќэ≥ЎЊёЉхЊё)§ђЌ≠ћЊ§«§є°•»а§ѕ°§•≥•н•§•…ќ≥ї“§ќ•÷•й•¶•у±њ∆∞°§µ§¬ќ§ќ«і≈ў°§•й•Є•¶•а§ќ¶Ѕјю§ќ¬ђƒк§ §…16Љпќа§ќ¬ђƒкЋ°§тƒу∞∆§Ј§∆§§§ё§є°•ЄљЇя°§§в§√§»§вјЇ≈ў§ќ§и§§¬ђƒкЋ°§ѕXјю§Ћ§и§лЈлЊљћ©≈ў¬ђƒк§»§§§п§м§∆§§§ё§є°•
•Џ°Љ•Є•»•√•„
°°2Њѕ •я•ѓ•н§ќј§≥¶§т§µ§∞§л°љЄґї“§ќєљ¬§°љ
1°•Ћ№ Єї≤Њ»
2°•
|
µ≠єж
|
Єґї“»÷єж(Z)
|
√жј≠ї“њф(N)
|
ЉЅќћњф(A)
|
≈≈ї“њф
|
≈≈≤ў
|
|
£і£±Ca£≤°№
|
20
|
21
|
41
|
18
|
+2
|
|
£іHe£≤°№
|
2
|
2
|
4
|
0
|
+2
|
|
£±£≥£єI°Ё
|
53
|
86
|
139
|
54
|
°Ё1
|
|
£≤£≥£µU
|
92
|
143
|
235
|
92
|
0
|
|
£±£є£ЈAu
|
79
|
118
|
197
|
79
|
0
|
3°•Ћ№ Єp35§ќћд¬к Є§ќƒыјµ
°°(Єн)£≤£≤Ne§ђ90.48°°Ґ™°°(јµ)£≤£∞Ne§ђ90.48
°°(Єн)£≤£∞Ne§ђ9.25°° Ґ™°°(јµ)£≤£≤Ne§ђ9.25
°°°°20.000°я 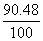 °№21.000°я
°№21.000°я 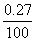 °№22.000°я
°№22.000°я 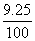 °б20.1877
°б20.1877
4°•E°бmc£≤
°°°°°°°°°б6°я(1.008665°№1.007276°№0.0005486)°я1.6605°я10°Ё£≤£Ј
kg°я(2.998°я10£Є m s°Ё£±)£≤
°°°°°°°°°б1.8057°я10°Ё£є J
5°• 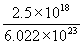 °я235°б9.76°я10°Ё£і g
°я235°б9.76°я10°Ё£і g
6°•(1) 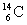 Ґ™ Ґ™ 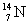 °№ °№ 
°°(2)»ЊЄЇіь(t£±°њ£≤)°б5730°я365°я24°я60°я60 s°б1.807°я10£±£±
s
°°°°°°°и°° ш≤хƒкњф(k)°б0.693°њt£±°њ£≤°б3.84°я10°Ё£±£≤s°Ё£±
°°(3) 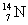 °№ °№ 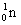 Ґ™ Ґ™ 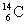 °№ °№ 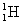
°°(4)Ћи…√37≤ѓЄƒ§ќ ш≤хњф§ЋЅк≈ц§є§лC°Њ14§ќЄґї“њф§тx§»§є§л§»
°°°°°°k°яx°б(3.84°я10°Ё£±£≤ s°Ё£±)°яx°б3.7
°я10£є°°°°°и°°x°б9.64°я10£≤£∞ Єƒ
°°§Ј§њ§ђ§√§∆°§•в•л§Ћієїї§Ј§∆14§т≥Ё§±§л§»
°°°°°°(9.64°я10£≤£∞°њ6.022°я10£≤£≥)°я14°б0.0224 g
7°•∞¬ƒк∆±∞ћ¬ќ§ќ•и°Љ•…(£±£≤£ЈI)•§•™•у§«іхЉб§Ј§∆є√ЊхЅ£§Ћ ьЉЌј≠•и°Љ•…§ђЉи§кєю§ё§м§л§≥§»§тЋ…§∞§њ§б°•
8°•log 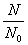 °бlog
°бlog 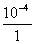 °б°Ё
°б°Ё 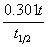 °б°Ё
°б°Ё 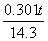 §и§к
§и§к
°°°°°°t°б190 ∆ь
•Џ°Љ•Є•»•√•„
°°3Њѕ •®•Ќ•л•Ѓ°Љ§ќ≥ђ√ §т§ќ§№§л°љЄµЅ«§ќЅ«ій°љ
1°•Ћ№ Єї≤Њ»
2°•(1)I°І[Kr]4d£±£∞ 5s£≤ 5p£µ°°°°(2)C°І[He]2s£≤
2p£≤°°°°(3)Si°І[Ne]3s£≤ 3p£≤
°°(4)P°І[Ne]3s£≤ 3p£≥°°°°(5)K°І[Ar]4s£±
3°•(1)Li°°°°(2)F°°°°(3)Ar°°°°(4)Cs°°°°(5)Al
4°•≈≈ї“«џ√÷°°[Kr]4d£±£∞ 5s£≤ 5p£ґ
°°•§•™•у°°I°Ё°§Cs°№°§Ba£≤°№
5°•Љюіь…љї≤Њ»
6°•(1)[He]2s£≤ 2p£ґ°°°°(2)[Ne]3s£≤ 3p£ґ°°°°(3)[He]2s£≤
2p£ґ
°°(4)[Ne]3s£≤ 3p£ґ°°°°(5)[Ar]3d£±£∞ 4s£≤
4p£≤
7°••Ґ•л•’•°•ў•√•»§ѕC
°°≠°C°§Cl°§Ca°§Cs
°°≠ҐCr°§Co°§Cu°§Cd
°°≠£Ce
°°≠§Cm°§Cf
8°•(1) ≥Ћ≈≈≤ў§ќЅэ≤√§Ћ§и§√§∆•ѓ°Љ•н•уќѕ§ђЅэ¬з§є§л§њ§б°•
°°(2)∆в≥Ћ≈≈ї“§ќЉ„§Ў§§Єъ≤ћ§ќ§њ§б°•
°°(3)NЄґї“§ќ2pµ∞∆ї§Ћ§ѕ3Єƒ§ќ≈≈ї“§ђ•’•у•»§ќµђ¬І§«∞м§ƒ§Ї§ƒЉэЌ∆§µ§м§∆§§§л§ђ°§OЄґї“§ќ2pµ∞∆ї§ѕ4Єƒћ№§ќ≈≈ї“§тЉэЌ∆§є§лЇЁ§Ћ°§≈≈ї“§…§¶§Ј§ќ»њ»ѓ§ђјЄ§Є§л§њ§б°•P§»£”§в∆±ЌЌ§ќіЎЈЄ°•
9°•E°бnh¶Ќ§и§к
°°°°°°E°б6.022°я10£≤£≥ mol°Ё£±°я6.626°я10°Ё£≥£і
J s°я 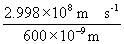 °б199 kJ mol°Ё£±
°б199 kJ mol°Ё£±
°°§и§√§∆°§…‘љЉ ђ°•
10°•h¶Ќ°б6.626°я10°Ё£≥£і°°J s°я 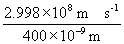 °б4.97°я10°Ё£±£є J°б3.10 eV
°б4.97°я10°Ё£±£є J°б3.10 eV
°°1•в•л§Ґ§њ§к§«§ѕ
°°°°°°4.97°я10°Ё£±£є J°я6.022°я10£≤£≥ mol°Ё£±°б299
kJ mol°Ё£±
11°•Љ∞(3°•24)§Ћ§™§§§∆°§dD(r)°њdr°б0§»§™§≠°§…‘Ќ„§ ґ¶ƒћ…ф ђ§тЊ√µо§є§л§»
°°°°°°r°Ёa£∞°б0
12°•1Ћь•№•л•»§«≤√¬Ѓ§µ§м§њ≈≈ї“§ќ¬Ѓ≈ў§ѕ
°°°° 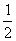 mv£≤°бeV°б1.602°я10°Ё£±£є°я10000°б1.602°я10°Ё£±£µ
J §и§к
mv£≤°бeV°б1.602°я10°Ё£±£є°я10000°б1.602°я10°Ё£±£µ
J §и§к
°°°°v£≤°б 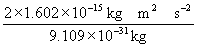 °б0.352°я10£±£ґ m£≤ s°Ё£≤°°°°°и°°v°б5.9°я10£Ј
m s°Ё£±
°б0.352°я10£±£ґ m£≤ s°Ё£≤°°°°°и°°v°б5.9°я10£Ј
m s°Ё£±
°°°°¶Ћ°б 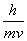 °б0.0123 nm
°б0.0123 nm
13°••„•й•у•ѓƒкњф§ќЉ°Єµ§ѕ°°°°[ЉЅќћ][ƒє§µ]£≤[їюі÷]°Ё£±
°°≥—±њ∆∞ќћ(mvr)°б [ЉЅќћ][¬Ѓ≈ў][ƒє§µ]°б[ЉЅќћ][ƒє§µ]£≤[їюі÷]°Ё£±
14°•ќг¬к3°•3ї≤Њ»°•
°°°°°°n°б 5°§l°б1.1 nm§т¬е∆ю§є§л§»
°°°°°°¶Ћ°б 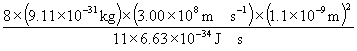 °б363 nm
°б363 nm
15°•њеЅ«§ќЄґї“≥Ћ°ћЌџї“°Ќ§ѕ≈≈ї“§ќЉЅќћ§ќ1836«№§«§Ґ§л°•≈≈ї“§ќЉЅќћ§тћµїл§Ј§ §§§»§є§л§»°§•®•Ќ•л•Ѓ°Љ(E£о)
§ќ∞м»ћЉ∞§ѕ°§E£о°б 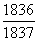 °я
°я  §»§ §л°•§є§ §п§Ѕ°§•®•Ќ•л•Ѓ°Љ§ѕ
§»§ §л°•§є§ §п§Ѕ°§•®•Ќ•л•Ѓ°Љ§ѕ 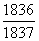 °б0.99945 Ѕк≈ц ђЄЇЊѓ§є§л°•§§§§§Ђ§®§м§–°§0.055°у§ј§±њеЅ«§ќ•®•Ќ•л•Ѓ°Љ§ѕЊеЊЇ§є§л°•
°б0.99945 Ѕк≈ц ђЄЇЊѓ§є§л°•§§§§§Ђ§®§м§–°§0.055°у§ј§±њеЅ«§ќ•®•Ќ•л•Ѓ°Љ§ѕЊеЊЇ§є§л°•
•Џ°Љ•Є•»•√•„
°°4Њѕ Єґї“§ђЉк§т§а§є§ў§–°љ≤љ≥ЎЈлєз§» ђї“°љ
|
1°•
|
(1)
|
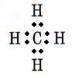
|
(2)
|
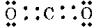
|
(3)
|
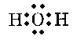
|
°° |
| °° |
(4)
|

|
(5)
|
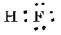
|
(6)
|
|
(7)
|
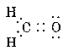
|
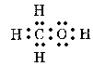
°°»уґ¶Ќ≠≈≈ї“¬–§ќњф°°(1)0°°(2)4°°(3)2°°(4)2°°(5)3°°(6)2°°(7)2
°°ґЋј≠§т§в§ƒ§в§ќ§ѕ°§(3)°§(5)°§(6)°§(7)°•
2°•(1)°¶(2)S£≤Cl£≤§™§и§”SCl£≤§ѕ°§SЄґї“§ќЉю§к§ќ≈≈ї“¬–§ђ4Єƒ§ §ќ§«јµїЌћћ¬ќЈњ§ќєљ¬§§»њдƒк§µ§м§л°•§ё§њ°§»уґ¶Ќ≠≈≈ї“¬–§ђ2Єƒ§Ґ§л§ќ§«°§§љ§ќ»њ»ѓ§Ћ§и§к109.5°л§и§к§вЊЃ§µ§ѓ§ §л§»ї„§п§м§л°•
°°(3)SCl£і§ѕ≈≈ї“¬–§ѕ5Єƒ§ §ќ§«ї∞≥—ќЊњн(ѕїћћ¬ќ)Јњ§»њдƒк§µ§м§л°•
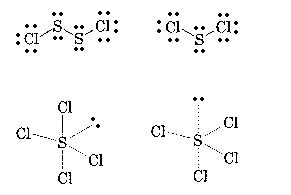
3°••Ј•єЈњ§»•»•й•у•єЈњ§ќ2Љпќа°•
4°••§•™•уЈлєз§ќ≥дєз°б  °я100°у§«§Ґ§л°•
°я100°у§«§Ґ§л°•
°°LiH§ќЊмєз°І ¶ћ(Љ¬¬ђ√Ќ)°б1.964°я10°Ё£≤£є C m
°°°°°° °°°° ¶ћ(Ј„її√Ќ)°б(1.602°я10°Ё£±£є C) °я(1.596°я10°Ё£±£∞ m)°б2.557°я10°Ё£≤£є
C m°°§Ј§њ§ђ§√§∆°§•§•™•уЈлєз§ќ≥дєз§ѕ
°°°°°° 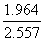 °я100°б76.8°у
°я100°б76.8°у
°°CO§ќЊмєз°І ¶ћ(Љ¬¬ђ√Ќ)°б0.37°я10°Ё£≥£∞ C m
¶ћ(Ј„її√Ќ)°б(1.602°я10°Ё£±£є C) °я(1.128°я10°Ё£±£∞ m)°б1.807°я10°Ё£≤£є
C m
°°§Ј§њ§ђ§√§∆°§•§•™•уЈлєз§ќ≥дєз§ѕ
°°°°°° 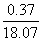 °я100°б2.05°у
°я100°б2.05°у
5°•њё4°•18ї≤Њ»°•N£≤§ѕ§є§ў§∆§ќ≈≈ї“§ђ¬–§тЇо§√§∆§™§к°§≈≈ї“§ќ•є•‘•у§ѕµ’ њє‘°§O£≤§ѕ(¶–°ц£≤£р)£≤§ќ2Єƒ§ќ≈≈ї“§ђ њє‘•є•‘•у(•»•к•„•м•√•»Њх¬÷)§Ћ§Ґ§л°£§Ј§њ§ђ§√§∆√вЅ« ђї“§ѕ»њЉІј≠°§їјЅ« ђї“§ѕЊпЉІј≠§«§Ґ§л°•
∞м э°§NO ђї“§ѕ(K≥ћ≈≈ї“)(¶“£≤£у)£≤(¶“°ц£≤£у)£≤(¶–£≤£р)£і(¶“£≤£р)£≤(¶–°ц£≤£р)£±§ќ≈≈ї“«џ√÷§т§в§Ѕ°§…‘¬–≈≈ї“§ђ§Ґ§л§ќ§«ЊпЉІј≠§»§ §л°•
|
6°•
|

|
(ґЋј≠§Ґ§к°§¶ћ°б1.85°§bp°б60°о)
|
| °° |
|
(ґЋј≠§ §Ј°§¶ћ°б0°§bp°б47°о)
|
°°•Ј•єЈњ(Ње¬¶)§ќ§џ§¶§ђ ®≈ј§ђєв§§°•
7°•(1)dE°њdr°б0§и§к°°°°r°бr£∞
°°(2)E(°з)°ЁE(r£∞)°бD
°°(3)Ј–Є≥≈™§ Љ¬Є≥Љ∞§«§ѕ§Ґ§л§ђ°§њё4°•1§»∆±ЌЌ§ќњё§ђЇ∆Єљ§µ§м§л°•
8°•CH£≥CH£≤°ЁH °№ Cl°ЁClҐ™CH£≥CH£≤°ЁCl
°№ H°ЁCl
°°°°°°°и°°¶§H°б414°№242°Ё327°Ё431°б°Ё102 kJ
mol°Ё£±
°°°°°°(¶§H£ж°л°б°Ё113 kJ mol°Ё£±)
9°•2 °я1.54 nm°яsin  °б2.51 nm
°б2.51 nm
10°•O£≤°№°І(K≥ћ≈≈ї“)(¶“£≤£у)£≤(¶“°ц£≤£у)£≤(¶“£≤£р)£≤(¶–£≤£р)£і(¶–°ц£≤£р)£±
ЈлєзЉ°њф°б(6°Ё1)°њ2°б2.5
°°°°O£≤°І(K≥ћ≈≈ї“)(¶“£≤£у)£≤(¶“°ц£≤£у)£≤(¶“£≤£р)£≤(¶–£≤£р)£і(¶–°ц£≤£р)£≤
°°°° ЈлєзЉ°њф°б(6°Ё2)°њ2°б2
°°°°O£≤°Ё°І(K≥ћ≈≈ї“)(¶“£≤£у)£≤(¶“°ц£≤£у)£≤(¶“£≤£р)£≤(¶–£≤£р)£і(¶–°ц£≤£р)£≥
°°°° ЈлєзЉ°њф°б(6°Ё3)°њ2°б1.5
O£≤£≤°Ё°І(K≥ћ≈≈ї“)(¶“£≤£у)£≤(¶“°ц£≤£у)£≤(¶“£≤£р)£≤(¶–£≤£р)£і(¶–°ц£≤£р)£і
°°°° ЈлєзЉ°њф°б(6°Ё4)°њ2°б1
°°§Ј§њ§ђ§√§∆°§Јлєзµчќ•§ќ¬з§≠§µ§ќљз§ѕ°°°°O£≤£≤°Ё°дO£≤°Ё°дO£≤°дO£≤°№
°°°°°°°°°°°°°°Јлєз•®•Ќ•л•Ѓ°Љ§ќ¬з§≠§µ§ќљз§ѕ°°°°O£≤°№°дO£≤°дO£≤°Ё°дO£≤£≤°Ё
11°•√вЅ« ђї“§»∆±ЌЌ§ќ≈≈ї“«џ√÷§»§Ј§∆
°°°°°°CO°І(K≥ћ≈≈ї“)(¶“£≤£у)£≤(¶“°ц£≤£у)£≤(¶–£≤£р)£і(¶“£≤£р)£≤(¶–°ц£≤£р)£∞
°°°°°°°°°°ЈлєзЉ°њф°б(6°Ё0)°њ2°б3
12°•3d£ш£щµ∞∆ї§»°§3s°§3p£ш°§3p£ъ§ќ≥∆µ∞∆ї§«§ѕ°§∞џ…дєж§ќљ≈§ §кј— ђ§ђЄя§§§Ћ¬«§ЅЊ√§Ј§Ґ§§°§Јлєз§ѕ§ƒ§ѓ§й§ §§°•3d£ш£щµ∞∆ї§»3p£щ§«§ѕ°§љ≈§ §кј— ђ§ђ¬«§ЅЊ√§Ј§Ґ§¶§≥§»§ђ§ §§§ќ§«Јлєз§т§ƒ§ѓ§л°•
°°°°°°3d£ш£щ°°°°°°3s°°°°°°°°3d£ш£щ°°°°°°°°3p£ш°°°°°°°°°°°°°°3d£ш£щ°°°°
3p£щ°°°°°°°°°°°°°°3d£ш£щ°°°°°°3p£ъ
13°•H§ќ1sµ∞∆ї§»F§ќ2p£ш°§2p£щ§ќ≥∆µ∞∆ї§«§ѕ°§∞џ…дєж§ќљ≈§ §кј— ђ§ђЄя§§§Ћ¬«§ЅЊ√§Ј§Ґ§§Јлєз§ѕ§ƒ§ѓ§й§ §§°•§Ј§њ§ђ§√§∆°§H§ќ1sµ∞∆ї§»F§ќ2s°§2p£ъ§ќ3§ƒ§ќµ∞∆ї§ђЇЃ§ґ§к§Ґ§√§∆њЈ§Ј§§3§ƒ§ќ ђї“µ∞∆ї§ђјЄ§Є§л°•
§≥§ќ§¶§Ѕ°§•®•Ќ•л•Ѓ°Љ§ќƒг§§∆у§ƒ§ќЈлєзј≠µ∞∆ї§Ћ4Єƒ§ќ≤Ѕ≈≈ї“§ђЉэ§ё§к°§∞¬ƒк§ ђї“§тЈЅјЃ§є§л°•
°°
•Џ°Љ•Є•»•√•„
°°5Њѕ •я•ѓ•н§ќј§≥¶§т•ё•ѓ•н§ќћ№§«°љ≤љ≥Ў«Ѓќѕ≥Ў§ќєЌ§® э°љ
1°•Ћ№ Єї≤Њ»
2°•°Ё279 kJ mol°Ё£±
3°•-891 kJ mol°Ё£±
4°•(1)-131 kJ mol°Ё£±°°°°(2)°Ё253 kJ mol°Ё£±°°°°(3)466 kJ
mol°Ё£±
°°(4)°Ё44 kJ mol°Ё£±
5°•w°бnRT ln 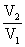 §Ћ°§n°б1 mol°§R°б8.314 J mol°Ё£± K°Ё£±°§T°б298
K§т¬е∆ю§Ј§∆
§Ћ°§n°б1 mol°§R°б8.314 J mol°Ё£± K°Ё£±°§T°б298
K§т¬е∆ю§Ј§∆
°°°°°°w°б8.314°я298°яln 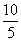 °б1.72 kJ
°б1.72 kJ
6°•Є«¬ќ§™§и§”±’¬ќ§ќЊмєз§ѕC£–°бC£÷°§µ§¬ќ§ќЊмєз§ѕC£–°бC£÷°№R§и§к°§R°б8.314
J mol°Ё£± K°Ё£± ђЇє§Ј∞ъ§§§∆
°°°°°°C£÷(Ar)°б12.6 J mol°Ё£± K°Ё£±°§C£÷(N£≤)°б20.7
J mol°Ё£± K°Ё£±
°°°°°°C£÷(H£≤O)°б75 J mol°Ё£± K°Ё£±°§C£÷(Ag)°б25.5
J mol°Ё£± K°Ё£±
7°•1g§Ґ§њ§к§ќƒк∞µ«≥Њ∆«Ѓ°б°Ё1.5 kJ°я17.8°б°Ё26.7 kJ§ §ќ§«°§•в•л§Ћієїї§є§л§»
°°°°°°Q£–°б122°я(°Ё26.7)°б°Ё3257 kJ
mol°Ё£±
§ё§њ°°°°ƒк∞µ«≥Њ∆«Ѓ(Q£–)°бƒкЌ∆«≥Њ∆«Ѓ(Q£÷)°№¶§nRT
§«§Ґ§к°§«≥Њ∆§ќ»њ±юЉ∞§ѕ
°°°°C£ЈH£ґO£≤°№7.5O£≤Ґ™7CO£≤°№3H£≤O(l)
§ §ќ§«°§¶§n°б7°Ё7.5°б°Ё0.5§тЊеЉ∞§Ћ¬е∆ю§є§л§»
°°°°Q£÷°б°Ё3257°Ё(°Ё0.5)°я8.314°я298°я10°Ё£≥°б°Ё3256
kJ mol°Ё£±
8°•Ї«љ™≈ю√£≤є≈ў§тT K§»§є§л§»°§
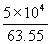 mol°я24.6 (J mol°Ё£± K°Ё£±)°я(343°ЁT)°№
mol°я24.6 (J mol°Ё£± K°Ё£±)°я(343°ЁT)°№ 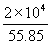 mol°я24.8(J mol°Ё£± K°Ё£±)(353°ЁT)
mol°я24.8(J mol°Ё£± K°Ё£±)(353°ЁT)
°б 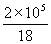 mol°я75(J mol-1 K-1)(T°Ё293)(J mol°Ё£±)
mol°я75(J mol-1 K-1)(T°Ё293)(J mol°Ё£±)
°°°°°°°и°°T°б294.7KҐ™21.7°о
9°•ќЊ ™¬ќ§ќ≈ю√£≤є≈ў§тT§»§є§л§»°§C£–(T£и°ЁT)°бC£–(T°ЁT£г)§и§к°§T°б(T£и+T£г)°њ2§«§Ґ§л°•§Ј§њ§ђ§√§∆°§«Ѓ§§ ™¬ќ§»ќд§њ§§ ™¬ќ§ќ§љ§м§Њ§м§ќ•®•у•»•н•‘°Љ —≤љ§ѕ
°°°°°°¶§S£и°бC£р ln 
°°°°°°¶§S£г°бC£р ln 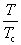
°°°°°°Ѕі•®•у•»•н•‘°Љ —≤љ(¶§S)°б¶§S£и°№¶§S£г°бC£–°°ln
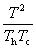
°°¶§S°д0§«§Ґ§л§≥§»§тЉ®§є§Ћ§ѕ°§ 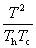 °д1§«§Ґ§л§≥§»§тЊЏћј§є§м§–§и§§°•§є§ §п§Ѕ
°д1§«§Ґ§л§≥§»§тЊЏћј§є§м§–§и§§°•§є§ §п§Ѕ
°°°°°° 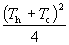 °дT£иT£г
°дT£иT£г
°°§Ћ§ §л§≥§»§тЉ®§ї§–§и§§°•ЊеЉ∞§т —ЈЅ§Ј§∆
°°°°°°T£и£≤°№2T£иT£г°№T£г£≤°д4T£иT£г
°°§µ§й§Ћ —ЈЅ§Ј§∆°§(T£и°ЁT£г)£≤°д0§ѕЉЂћј§«§Ґ§л§ќ§«°§¶§S°д0§»§ §л°•
10°•¶§S°б100°я4.184(ln 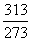 °№ln
°№ln 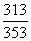 )°б6.89 J K°Ё£±
)°б6.89 J K°Ё£±
11°•ње§ќЊмєз§ѕ¬ќј— —≤љ§ѕ§ §§§в§ќ§»§Ј§∆
°°°°°°¶§G°бV(P£≤°ЁP£±)°б18.05(cm£≥)°я(10°Ё1)(atm)
°°§и§√§∆
°°°°°°¶§G°б162.5°я10°Ё£ґ(£н£≥)°я1.01325°я10£µ(N
m°Ё£≤)°б16.4 J
°°їјЅ«§ќЊмєз§ѕ¬ќј— —≤љ§є§л§ќ§«
°°°°°°¶§G°бRT ln 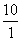 °б8.314°я298°я2.303°б5706 J
°б8.314°я298°я2.303°б5706 J
12°•¶§G°л°б°Ё2.303°я8.314°я298°яlog 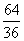 °б°Ё1.43 kJ mol°Ё£±
°б°Ё1.43 kJ mol°Ё£±
13°•ln 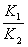 °б°Ё
°б°Ё 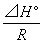 (
( 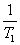 °Ё
°Ё 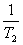 )§и§к
)§и§к
°°°°°°ln 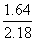 °б°Ё
°б°Ё 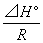 (
( 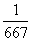 °Ё
°Ё 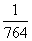 )
)
°°°°°°°и°°¶§H°л°б12.4 kJ mol°Ё£±
14°•…љ5°•1§и§к
°°°°°°¶§H°л°б¶§H£ж°л(CaO)°№¶§H£ж°л(CO£≤)°Ё¶§H£ж°л(CaCO£≥)
°°°°°°°°°°°б°Ё635°№(°Ё394)°Ё(°Ё1207)°б178 kJ mol°Ё£±
°°…љ5°•7§и§к
°°°°°°¶§S°л°б S°л(CaO) + S°л(CO£≤) °Ё S°л(CaCO£≥)°б40°№214°Ё93°б161
J K°Ё£± mol°Ё£±
°°§Ј§њ§ђ§√§∆°°°°¶§G°л°б¶§H°л°Ё T¶§S°л°б 178°Ё298°я0.161°б130
kJ mol°Ё£±
15°•(1)±’¬ќ§Ђ§йµ§¬ќ§Ў§ќ —≤љ§ §ќ§«°§¶§S°л°д0§«§Ґ§л°•
°°(2)µ§¬ќ»њ±ю§« ™ЉЅќћ§ѕЄЇЊѓ§Ј§∆§§§л§ќ§«°§¶§S°л°г0§«§Ґ§л°•
°°(3)∆у§ƒ§ќ•§•™•у§Ђ§й1 ђї“§ђјЄ§Є§∆§§§л§ќ§«°§Јѕ§ќ•®•у•»•н•‘°Љ§ѕЄЇЊѓ§є§л°£§є§ §п§Ѕ°§¶§S°л°г0§«§Ґ§л°•
•Џ°Љ•Є•»•√•„
°°6Њѕ ™ЉЅ§ќЅ«ій§т§µ§∞§л°љµ§¬ќ°¶±’¬ќ°¶Є«¬ќ§ќј≠ЉЅ°љ
1°• њґ— ђї“ќћ°І0.21°я32°№0.78°я28°№0.01°я40°б29
°°°°°°ћ©≈ў°І29 g°а(22.4 dm£≥)°б1.29 g dm°Ё£≥
2°•KClO£≥§ќ•в•лњф°б100°њ122.6 mol°б0.816 mol
°°°°°°°и°°O£≤§ќ•в•лњф°б1.5°я0.816 °б1.224 mol
°°18°о°§1000•Ў•ѓ•»•—•є•Ђ•л§«§ќїјЅ«§ќ¬ќј—(V)§ѕ
°°°°°°V°б(1.224 mol)°я(0.0821 l atm K°Ё£± mol°Ё£±)°я(291
K)°я 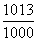 °б29.6 l(dm£≥)
°б29.6 l(dm£≥)
3°•њеЅ«§ќ¬Ѓ≈ў°ІїјЅ«§ќ¬Ѓ≈ў°б 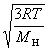 °І
°І 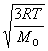 °б
°б 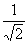 °І
°І 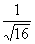 °б4°І1
°б4°І1
°°њеЅ«§ќ¬Ѓ≈ў§»∆±§Є¬Ѓ≈ў§Ћ§є§л§Ћ§ѕїјЅ«§ќ≤є≈ў§т°§4£≤°я300K°б4800 K§Ћ§є§л°•
4°•(1) 6.94 atm (2) 6.76 atm
5°•(101.325°Ё63.5)°я0.21°б7.9 kPa
6°•(1)SO£≤°ІґЋј≠§ђ§Ґ§л§ќ§«°•
(2) Br£≤°І≈≈ї“њф§ђ¬њ§§§ќ§«•’•°•у•«•л•п°Љ•л•єќѕ§в¬з§≠§ѓ§ §л§Ђ§й°•
(3) C£≤H£µOH°ІњеЅ«Јлєз§Ј§∆§§§л§ќ§«°•
(4) n°Ё•Џ•у•њ•у°ІƒЊЇњЊх•Ґ•л•Ђ•у§ќ э§ђј№њ®ћћј—§ђ¬з§≠§§§ќ§«°•
(5) Xe°ІXe§ќ э§ђ≈≈ї“њф§ђ¬њ§§§ќ§«°•
7°•Љ∞(6°Ё17)§Ћ°§P°б1 atm°§T°б373 K§т¬е∆ю§Ј§њЉ∞§»°§P°б0.33 atm°§µб§б§л ®≈јT§т¬е∆ю§Ј§њЉ∞§т ’°є∞ъ§≠її§Ј§∆
°°°°°°¶§H°б40.7 kJ mol°Ё£±
°°R°б8.314 J mol°Ё£± K°Ё£±§и§к°°°°T°б344 K°б71°о
•Џ°Љ•Є•»•√•„
°°7Њѕ њє’§Ћґб§§Јѕ°§±у§§Јѕ°љЌѕ±’°§їј°¶±цір°§їј≤љ°¶і‘Єµ°љ
1°••є•ѓ•н°Љ•є§ќ ђї“ќћ°б342
(1)•є•ѓ•н°Љ•є§ќ•в•лњф§ѕ°°°° 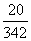 °б0.05848 mol
°б0.05848 mol
°°§≥§м§ђ°§1020g°б1.02 dm£≥√ж§Ћ¬ЄЇя§є§л§ќ§«°°°°0.05848°а1.02°б0.0573
mol dm°Ё£≥
(2) 0.05848°а(0.05848°№ 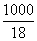 )°я100°б0.105 mol °у
)°я100°б0.105 mol °у
(3) ¶∞°бcRT°б0.0573°я0.08206°я293°б1.38 atm
(4) 20°о§ќње§ќЊшµ§∞µ§ѕ17.536 mmHg°••й•¶°Љ•л§ќЋ°¬І§и§к
°°°°°°0.018mmHgєя≤Љ(2.4°я10°Ё£µatmєя≤Љ)
(5) ¶§T£в°б0.51°я0.05848°б0.030°°°°°и°° ®≈ј°б100.03°о
2°•¶∞°бcRT§и§к
°°°°°°c°б¶∞°њRT°б7.6 atm°а(0.08206 l atm K°Ё£±
mol°Ё£±)°а(293K)°б0.311 mol l°Ё£±
°°NaClҐ™Na°№°№Cl°Ё§Ћ≤тќ•§є§л§ќ§«°§њ©±ц§ќ«ї≈ў§ѕ§≥§ќ»Њ ђ(0.155
mol l°Ё£±)§«§и§§°•
3°•¶§T°бK£ж°яm§и§к
°°°°°°m°б15 °о°њ (1.86 °о kg mol°Ё£±)°б8.06 mol
kg°Ё£±
§Ј§њ§ђ§√§∆°§•®•Ѕ•м•у•∞•к•≥°Љ•л§ќ ђї“ќћ(62.1g mol°Ё£±)§Ђ§й
°°°°2°я8.06°я62.1°б1001£з
§»§ §к°§¬ќј—§Ћієїї§є§л§»
°°°°1.001°њ1.11°б0.90 l
§ђ…ђЌ„°•
4°•їюі÷(s)°я125 A°б 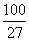 °я3°я9.65°я10£і C
°я3°я9.65°я10£і C
°°°°°°°и°°їюі÷°б8.6°я10£≥ s°б2.4 h
5°•(1)≈≈√”§ќ»њ±ю§ѕ°°°°Zn°№Cu£≤°№Ґ™Zn£≤°№°№Cu
•Ќ•л•у•є•»§ќЉ∞(7°•11)§Ћ≥∆ƒкњф§т¬е∆ю§Ј°§√±∞ћ§т•№•л•»§« ≈э∞м§є§л§»
°°°°E°бE£∞°Ё 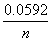 log Q
log Q
§«…љ§ї§л°•§≥§≥§«°°°°…Єља≈≈∞ћE£∞°б0.34°Ё(°Ё0.76)°б1.10 V
°°°°°и°°E°бE£∞°Ё 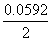 log (Zn£≤°№°њCu£≤°№)°б1.10°Ё0.0296 log(10°Ё£±°њ10°Ё£є)
log (Zn£≤°№°њCu£≤°№)°б1.10°Ё0.0296 log(10°Ё£±°њ10°Ё£є)
°°°°°°°° °б1.10°Ё(0.0296)°я8°б0.86 V
(2)¶§G°б°ЁnFE°б°Ё2°я(9.65°я10£і)°я(0.86)°б°Ё166
kJ
6°•[HA]°бC£б°§[BA]°бC§»§є§л§»°°°°pH°бpK£б°№log(C°њC£б)
(1) C°бC£б°б0.5 mol dm°Ё£≥§ §ќ§«°°°°pH°бpK£б
(2) «ї≈ў»жC°њC£б §ѕ —§п§й§ §§§ќ§«°§pH§ѕ∞мƒк§«§Ґ§л°•
(3) C°б(0.5°њ1.1) mol dm°Ё£≥°§C£б°б(0.6°њ1.1)mol
dm°Ё£≥§и§к
°°°°«ї≈ў»жC°њC£б°б0.83°°°°°и°°pH§ќ —≤љ°бlog0.83°б°Ё0.08
(4) C°б(0.6°њ1.1) mol dm°Ё£≥°§C£б°б(0.4°њ1.1)
mol dm°Ё£≥§и§к
°°°°«ї≈ў»жC°њC£б°б1.5°°°°°и°°pH§ќ —≤љ°бlog1.5°б0.18
•Џ°Љ•Є•»•√•„
°°8Њѕ Њг …§т±џ§®§м§–°љ≤љ≥Ў»њ±ю§»¬Ѓ≈ў°љ
1°•Ћ№ Єї≤Њ»
2°•љй«ї≈ў§тa°§їюі÷t£±Єе°§t£≤Єе§ќ«ї≈ў§т§љ§м§Њ§мa£±°§a£≤§»§Ј°§≥∆Љ∞§Ћt£±°б50 ђ°§a£±°б0.8a°§a£≤°б0.4a§т¬е∆ю§є§л°•
(1)Љ∞(8°•6)§и§к°°°°a£±°бa°Ёk°я50°°°°a£≤°бa°Ёk°яt£≤
°°Њеµ≠§ќ√Ќ§т¬е∆ю§Ј°§ ’°є§п§кїї§є§л§»°°°°t£≤°б150 ђ
(2)Љ∞(8°•9)§и§к°°°°ln a£±°бln a°Ёt£±k°°°°ln
a£≤°бln a°Ёt£≤k
°°Њеµ≠§ќ√Ќ§т¬е∆ю§Ј°§ ’°є§п§кїї§є§л§»°°°°t£≤°б205 ђ
(3)Љ∞(8°•14)§и§к°°°° 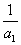 °бt£±k°№
°бt£±k°№ 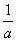 °°°°
°°°° 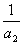 °бt£≤k°№
°бt£≤k°№ 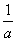
°°Њеµ≠§ќ√Ќ§т¬е∆ю§Ј°§ ’°є§п§кїї§є§л§»°°°°t£≤°б300 ђ
3°•99.9°у»њ±ю§є§л§ќ§ЋЌ„§є§лїюі÷§тt£±§»§Ј°§50°у»њ±ю§є§л§ќ§ЋЌ„§є§лїюі÷§тt£≤§»§є§л§»°§t°б
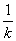 ln
ln 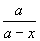 §и§к
§и§к
°°°°°° 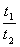 °бln
°бln 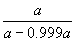 °њln
°њln  °бlog1000°њlog2Ґв10
°бlog1000°њlog2Ґв10
4°•Љ∞(8°•26)§и§к
°°°°°°log 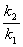 °б
°б 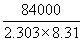 °я
°я 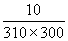 °б0.472
°б0.472
°°°°°°°и°°k£≤°њk£±°б2.96 («№)
5°••¶•й•у§ќ«ї≈ў§ђ4 ђ§ќ1§Ћ§ §√§∆§§§л§ќ§«°§•¶•й•у§ќљй«ї≈ў§тa§»§є§л§»°§Љ∞(8°•9)§и§к
°°°°°°ln  °бln a°Ёkt£±°°°°ln
°бln a°Ёkt£±°°°°ln 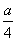 °бln a°Ёkt£≤
°бln a°Ёkt£≤
°°t£±°б45≤ѓ«ѓ°§a£±°б 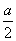 °§a£≤°б
°§a£≤°б 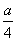 §т§љ§м§Њ§м¬е∆ю§Ј§∆°§ ’°є§п§кїї§є§л§»
§т§љ§м§Њ§м¬е∆ю§Ј§∆°§ ’°є§п§кїї§є§л§»
°°°°°° 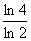 °б
°б 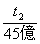 °°°°°и°°t£≤°б90≤ѓ«ѓ
°°°°°и°°t£≤°б90≤ѓ«ѓ
6°•E£б(cisҐ™trans)°бE£б(transҐ™cis)°Ё¶§H°б224°Ё4.2°б220
kJ
7°•(1) 8«№§Ћ§ §л°•°°(2) 4«№§Ћ§ §л°•°°(3) 1°њ8«№§Ћ§ §л°•
8°•Љ∞(8°•26)§и§к
°°°°°°E£б°б 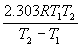 °яlog
°яlog 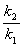 °б(119 kJ mol°Ё£±)°я(log 9.4)°б116 kJ mol°Ё£±
°б(119 kJ mol°Ё£±)°я(log 9.4)°б116 kJ mol°Ё£±
9°•(1) ∞ ≤Љ§ќ…љ§ќ§и§¶§Ћ°§ln(a°Ёx)§»t§ђƒЊјюіЎЈЄ§Ћ§Ґ§л§ќ§«∞мЉ°»њ±ю°•
(2) (1)§ќƒЊјю§ќЈє§≠§ђ¬Ѓ≈ўƒкњф(k)§ЋЅк≈ц§є§л°•
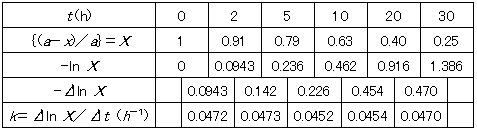
°°°°°°°и°°ƒЊјю§ќЈє§≠§ќ њґ—Ґв0.046 h°Ё£±
10°•љйіь«ї≈ў§ђ∆±§Є§ §ќ§«°§Љ∞(8°•14)§тЌ—§§§∆
°°°° 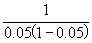 °б0.137t°№
°б0.137t°№ 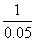 °°°°°и°°t°б7.7 s
°°°°°и°°t°б7.7 s
•Џ°Љ•Є•»•√•„
|

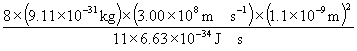 °б363 nm
°б363 nm